Le diagnostic génétique préimplantatoire (DPI) est une analyse génétique des embryons obtenus par fécondation in vitro (FIV) dans le but de sélectionner des embryons sains ayant la capacité d'être implantés.
De plus, le DPI est la technique la plus indiquée pour éviter la transmission d'une maladie génétique héréditaire, car il permet de détecter les embryons présentant des mutations dans leur ADN, qui seront rejetés pour leur transfert dans l'utérus.
Le DPI doit être effectué par des experts en embryologie et en génétique, car il requiert des techniques très délicates telles que la biopsie de blastomères et les techniques de génétique moléculaire.
Vous trouverez ci-dessous un index des 9 points que nous allons aborder dans cet article.
- 1.
- 2.
- 2.1.
- 2.2.
- 3.
- 3.1.
- 3.2.
- 4.
- 4.1.
- 4.2.
- 5.
- 6.
- 6.1.
- 6.2.
- 6.3.
- 6.4.
- 6.5.
- 7.
- 8.
- 9.
Le DPI étape par étape
La FIV avec DPI est l'un des traitements les plus laborieux de la procréation assistée et comporte donc plusieurs étapes, de la stimulation ovarienne au transfert d'embryon. Nous les commentons ci-dessous :
- FIV
- consiste à effectuer une stimulation ovarienne sur la femme, à obtenir les ovules par ponction folliculaire et, enfin, à féconder les ovules avec le sperme du partenaire masculin ou d'un donneur anonyme.
- Développement embryonnaire
- les caractéristiques des embryons en culture sont évaluées quotidiennement, car pour effectuer la biopsie, il est nécessaire qu'ils aient un niveau de qualité minimum pour assurer leur survie.
- Biopsie cellulaire
- extraction d'un ou plusieurs blastomères (cellules de l'embryon) pour une analyse génétique ultérieure. Elle peut être effectuée au troisième jour des embryons ou, une fois qu'ils ont atteint le stade de blastocyste, au cinquième jour. La cellule prélevée est ensuite soigneusement placée dans un tube, un processus connu sous le nom de tubing.
- Analyse génétique
- l'étude des chromosomes et/ou des gènes des cellules biopsiées afin d'identifier les éventuelles altérations de celles-ci. Plus précisément, l'analyse des chromosomes est mieux connue sous le nom de dépistage génétique préimplantatoire et, d'autre part, le terme DPI est utilisé pour l'analyse de mutations génétiques spécifiques.
- Transfert d'embryons
- les embryons génétiquement sains sont sélectionnés pour être transférés dans l'utérus de la mère ou pour être cryopréservés en vue de futures tentatives.
Il convient de noter que le transfert d'embryons peut se faire en cycle frais ou différé. Cela dépendra du temps nécessaire pour obtenir les résultats de l'analyse génétique, et il est assez fréquent que les embryons doivent être congelés
Si vous devez faire un traitement de fécondation in vitro pour devenir maman, nous vous recommandons d'utiliser le Rapport sur la fertilité. En 3 étapes simples, qui vous permettra de connaître les cliniques à l’étranger qui répondent à nos critères de qualité rigoureux. En outre, vous recevrez un rapport contenant des conseils utiles avant de réaliser des visites dans les cliniques.
Biopsie d'embryon
La biopsie d'embryon est le processus d'extraction d'une ou plusieurs cellules, appelées blastomères, afin d'analyser l'ADN des embryons pour détecter toute altération génétique.
La viabilité de l'embryon peut être compromise par cette biopsie, car la perte d'une cellule peut être trop stressante pour que l'embryon survive. Il est donc nécessaire que cette extraction de cellules soit effectuée par un personnel de laboratoire hautement spécialisé et expérimenté.
Le Dr Antonio Alcaide, embryologiste spécialiste du DPI, explique les particularités de ce processus :
Le prélèvement de la cellule pour analyse dans le cadre d'un diagnostic préimplantatoire se fait par biopsie. Un petit trou doit être fait dans la couche la plus externe de l'embryon et une des cellules doit être retirée, puis l'ADN du noyau de cette cellule doit être analysé.
La biopsie de l'embryon peut être effectuée au jour 3 ou au jour 5. Dans les deux cas, il est essentiel que la fécondation se fasse par le biais d'un ICSI.
Dans la FIV conventionnelle, il y a des spermatozoïdes et des cellules de granulosa attachés à la zone pellucide de l'embryon. Cela pose un risque de contamination des blastomères extraits et le DPI pourrait donc donner un résultat altéré.
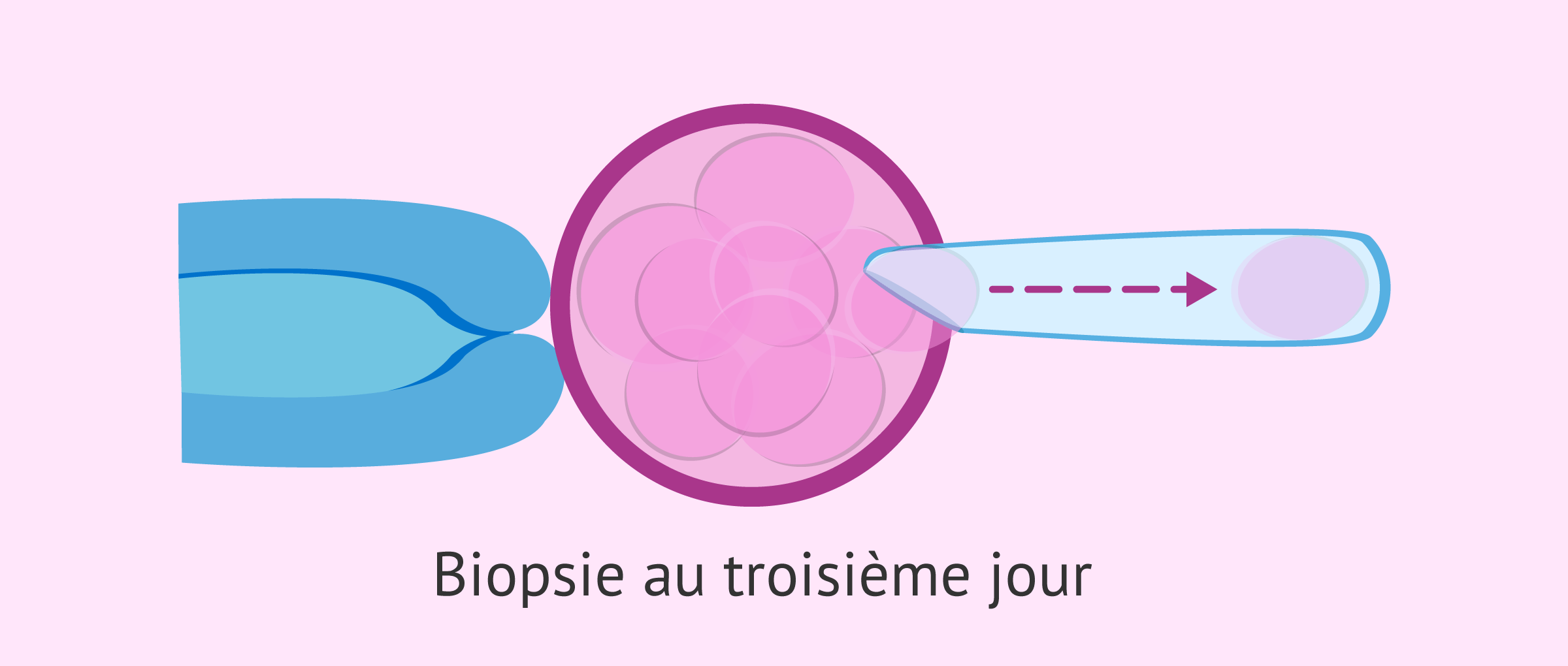
Biopsie du blastomère au troisième jour
Au troisième jour du développement embryonnaire, les embryons de bonne qualité ont généralement 8 cellules, mais ils peuvent aussi en avoir entre 6 et 10 selon leur taux de division.
Par conséquent, si la biopsie est effectuée à ce moment précis, un seul, ou au maximum deux, blastomères seront prélevés de l'embryon afin de ne pas compromettre sa viabilité.
Au cours de la procédure, un trou est fait dans la zone pellucide de l'embryon au moyen d'impulsions laser ou d'agents chimiques, tels que l'acide tyrolien. Une fois ce trou fait, le blastomère est retiré par aspiration.
Après la biopsie de l'embryon, il existe deux options possibles pour les embryons :
- La culture des blastocystes
- les embryons sont laissés en culture pour poursuivre leur évolution en attendant les résultats de l'analyse génétique. Par conséquent, le transfert d'embryons sera au stade de blastocyste au cinquième jour.
- Vitrification de l'embryon.
- les embryons sont congelés après la biopsie pour être transférés dans un cycle ultérieur.
Si vous souhaitez en savoir plus sur ce sujet, vous pouvez accéder au post suivant : Transfert d'embryons congelés.
Biopsie du trophoectoderme le 5e jour
Au cinquième jour de son développement, l'embryon est devenu ce que l'on appelle un blastocyste. C'est un embryon plus grand, composé d'une multitude de cellules et de 3 parties différenciées :
- Masse cellulaire interne (MCI)
- donne naissance au futur fœtus.
- Blastocele
- est une cavité interne remplie de fluide.
- Trophoectoderm
- couche externe à l'origine du placenta et d'autres structures extra-embryonnaires.
Bien qu'il s'agisse de populations cellulaires différentes, les cellules MIC et trophoectodermiques ont le même matériel génétique. Il est donc possible d'extraire quelques cellules de cette couche externe pour les analyser avec le DPI.
Le fait que plusieurs cellules puissent être extraites de l'embryon est un avantage, car un résultat plus fiable sera obtenu, il sera possible de détecter les cas de mosaïcisme et, en outre, la viabilité de l'embryon ne sera pas aussi compromise.
Lors de la biopsie d'un blastocyste, il faut veiller à faire le trou dans un endroit éloigné de la MCI afin d'éviter d'éventuels dommages.
D'autre part, il est plus pratique d'utiliser les courtes impulsions du laser pour percer la zone pellucide que l'acide Tyrodes, car il a considérablement réduit son épaisseur à mesure que le blastocyste se dilate et l'utilisation d'un agent chimique pourrait l'endommager.
Ensuite, une fois qu'un trou suffisant a été fait pour insérer la pipette à biopsie, les cellules sont prélevées par aspiration. Pour séparer les cellules à retirer de celles qui restent à l'intérieur de l'embryon, les impulsions laser peuvent aider.
Dans ce cas, il sera nécessaire de vitrifier les embryons après la biopsie afin de les transférer dans un cycle ultérieur, car les résultats de l'analyse génétique prennent plusieurs jours et il ne serait pas viable de laisser les embryons en culture.
Vous trouverez toutes les informations à ce sujet dans le prochain article : Les taux d'implantation des blastocystes congelés.
Dépistage génétique préimplantatoire
Le test génétique préimplantatoire, également connu sous le nom de DPI, est un type de DPI dans lequel les aneuploïdies possibles des embryons sont analysées.
Les aneuploïdies sont des altérations du nombre ou de la structure des chromosomes, compte tenu du fait que la dotation chromosomique humaine normale est de 46 chromosomes. Par conséquent, le gain ou la perte d'un chromosome, ainsi que les changements dans sa structure, sont des anomalies qui peuvent entraîner des embryons non viables ou des nouveau-nés atteints de maladies chromosomiques telles que le syndrome de Down.
Dans certaines cliniques, ce type de DPI est également appelé dépistage de l'aneuploïdieet les tests génétiques utilisés pour leur détection sont ceux qui sont abordés dans les sections suivantes.
Etude FISH
L'hybridation fluorescente in-situ (FISH) est la technique traditionnellement utilisée pour l'étude des anomalies chromosomiques.
Il ne permet d'analyser que certaines régions de 9 chromosomes (13, 15, 16, 17, 18, 21, 22, X et Y). Cependant, ces chromosomes sont impliqués dans des aneuploïdies qui peuvent entraîner des fausses couches à répétition ou la naissance d'enfants malades.
Le processus consiste à ajouter des sondes fluorescentes pour des régions spécifiques des chromosomes à analyser. Il est alors possible de visualiser le signal fluorescent à l'aide d'un microscope spécial et de détecter si l'une des régions analysées est manquante ou, au contraire, s'il y a plus de copies qu'elles ne devraient l'être.
Comme l'analyse d'un certain nombre de chromosomes seulement est une limitation, la FISH est considérée comme une analyse incomplète et est actuellement remplacée par d'autres techniques qui permettent une analyse génétique complète de l'embryon.
CGH Arrays
L'hybridation génomique comparative (A-CGH) est une technique qui nous permet d'effectuer un dépistage complet des chromosomes (CCS), c'est-à-dire que les 23 paires de chromosomes sont analysées en même temps à la recherche de régions présentant une certaine altération chromosomique.
Pour effectuer cette analyse génétique, on utilise un ADN de contrôle et l'échantillon d'ADN à étudier de la cellule embryonnaire extraite. Les deux brins d'ADN sont marqués avec des sondes fluorescentes différentes, puis hybridés dans le microarray.
Cette méthodologie permet de comparer l'ADN de l'embryon avec celui de l'échantillon de référence et d'identifier les pertes (délétions) ou les gains (duplications) de matériel génétique, qui pourraient entraîner des défauts embryonnaires.
Bien que cette technique soit beaucoup plus décisive que la pêche, elle ne fait que des comparaisons quantitatives, c'est-à-dire qu'elle détecte s'il y a du matériel génétique manquant ou excédentaire. Par conséquent, il ne détecte pas s'il y a des fragments de chromosomes qui ne sont pas au bon endroit, comme les inversions ou les translocations.
DPI pour les maladies monogéniques
Les maladies monogéniques sont celles causées par des mutations dans un seul gène, comme la mucoviscidose, l'hémophilie ou le syndrome de l'X fragile.
De plus, il s'agit de maladies héréditaires qui se transmettent des parents aux enfants. Par conséquent, avant de procéder au DPI sur les embryons, il est nécessaire d'identifier la mutation spécifique chez les parents par une étude d'informativité.
Une fois la mutation localisée et le type d'héritage déterminé (dominant, récessif ou lié au sexe), il est possible d'étudier les embryons à l'aide des outils génétiques évoqués ci-dessous.
PCR
La réaction en chaîne de la polymérase (PCR) implique l'amplification de séquences d'ADN spécifiques pour une analyse plus approfondie. Ainsi, il est possible d'obtenir des millions de copies du gène d'intérêt à partir d'une seule copie présente dans la cellule extraite.
Une fois que la séquence souhaitée a été amplifiée, différentes techniques de biologie moléculaire sont utilisées pour l'analyser et localiser les éventuelles mutations qui donnent lieu à des maladies monogéniques.
Séquence de masse
Le séquençage de la prochaine génération(NGS) est la technique la plus avancée pour les études génétiques aujourd'hui.
Les avantages qu'elle offre par rapport à d'autres techniques sont les suivants :
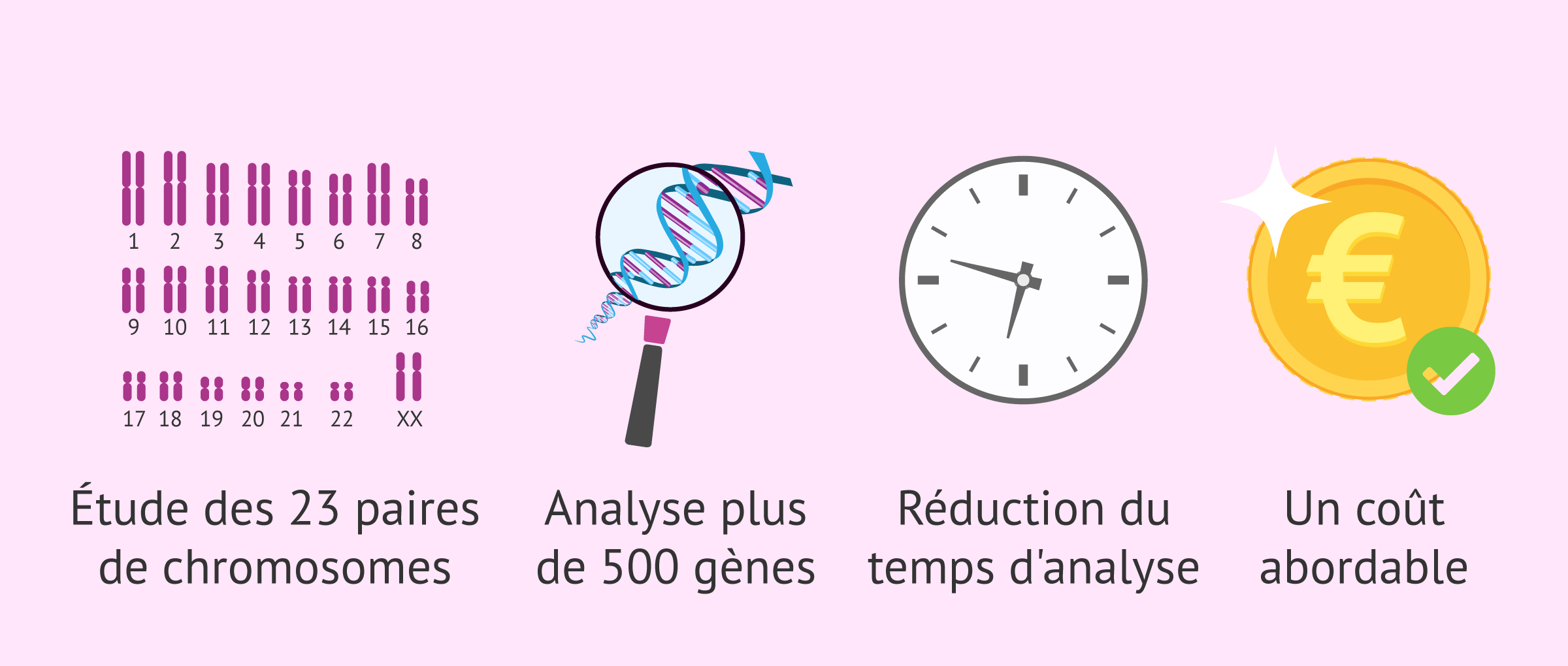
- Il permet d'étudier les 23 paires de chromosomes dans la même analyse, et avec une résolution plus élevée.
- Il permet l'analyse simultanée de plus de 500 gènes associés à des maladies héréditaires.
- Il est possible d'étudier les aneuploïdies et les maladies monogéniques séparément ou simultanément dans une seule analyse.
- Réduction du temps d'analyse, ce qui évite de devoir congeler les embryons en attendant les résultats.
- Il permet d'analyser un grand nombre d'échantillons en même temps, ce qui rend le coût de l'analyse plus abordable.
Aujourd'hui, de plus en plus de cliniques optent pour cette technologie de pointe, tant pour le dépistage de l'aneuploïdie que pour la détection des maladies monogéniques.
Transfert d'embryons sains
Une fois les résultats obtenus, les embryons sains seront transférés dans l'utérus de la mère ou vitrifiés pour de futures tentatives. Les embryons présentant des altérations génétiques sont rejetés, même s'ils ont apparemment une bonne qualité morphologique.
Si les embryons ont été vitrifiés avant les résultats, ils seront transférés dans un cycle substitué. Pour ce faire, la femme devra faire une préparation endométriale avec l'administration d'œstrogènes et de progestérone.
Si les résultats montrent qu'il existe plusieurs embryons exempts d'anomalies, seul le ou les embryons présentant la meilleure qualité morpho-cinétique pour le transfert seront décongelés, ce qui augmentera la probabilité d'implantation.
Vos questions fréquentes
Le DPI et le PGT sont-ils la même chose ?
Ce sont les acronymes des études génétiques qui sont effectuées sur un embryon avant son transfert dans l'utérus. D'une part, le DPI se réfère au diagnostic génétique préimplantatoire, tandis que le PGT signifie test génétique préimplantatoire.
Actuellement, le terme le plus couramment utilisé pour cette technique complémentaire est PGT.
Quels sont les avantages d'un DPI ?
Aunque morfológicamente un embrión tenga buen aspecto, puede ocurrir que genéticamente no sea normal y dar lugar a fallos de implantación al transferirlo al útero o, lo que es peor, que tenga lugar un embarazo no viable que termine en aborto espontáneo.
También puede pasar que implante un embrión con alguna cromosomopatía o alteración genética compatible con la vida y, finalmente, nazca un bebé con alguna enfermedad grave.
Gracias al DGP, se pueden seleccionar aquellos embriones genéticamente sanos antes de su transferencia al útero, reduciendo las tasas de aborto y aumentando las de recién nacido vivo.
Le fait de retirer une ou plusieurs cellules de l'embryon peut-il nuire à son développement ultérieur ?
Oui, le processus peut compromettre la viabilité de l'embryon, car la perte de certaines cellules peut être trop stressante pour qu'il puisse survivre. Malgré cela, le taux de survie est très élevé, surtout lorsque le DPI est effectué dans des blastocystes, car ces embryons possèdent un plus grand nombre de cellules que ceux du troisième jour et, par conséquent, peuvent se rétablir plus facilement après la biopsie.
Le DPI est-il meilleur le troisième ou le cinquième jour ?
Il est préférable de faire un DPI au cinquième jour, lorsque l'embryon est au stade de blastocyste, car il est plus développé et permet d'analyser un plus grand nombre de cellules, ce qui améliore le diagnostic et réduit les possibilités d'erreur.
En outre, les cellules biopsiées dans le blastocyste proviennent du trophoectoderme, la partie externe de l'embryon, de sorte que toutes les cellules qui donneront naissance au futur fœtus sont conservées intactes.
Peut-on faire une biopsie du corpuscule polaire ?
Bien que la procédure la plus courante en matière de DPI consiste à effectuer une analyse génétique des embryons, il est également possible d'analyser le contenu génétique des ovules obtenus pour la FIV au moyen d'une biopsie du corpuscule polaire.
Les corpuscules polaires sont des cellules sans fonction qui se forment lors de la méiose et disparaissent instantanément après la fécondation. La biopsie du corpuscule polaire est donc effectuée avant la fécondation. De cette façon, les ovules ayant les meilleures possibilités de parvenir à un bon développement de la grossesse sont sélectionnés.
L'analyse d'une de ces cellules n'affectera pas le développement futur de l'embryon. Cependant, il ne pourra pas détecter les anomalies qui se produisent après la fécondation et ne fournira pas non plus d'informations génétiques d'origine paternelle, mais uniquement d'origine maternelle.
La rédaction vous recommande
Tout au long de cet article, nous avons fait remarquer que le DPI sert à détecter les anomalies génétiques et chromosomiques chez les embryons. Si vous voulez savoir quelles maladies spécifiques résultent de ces altérations, vous pouvez lire ici : Quelles maladies génétiques ou chromosomiques le DPI peut-il détecter ?
Pour obtenir des informations sur les taux de réussite de cette technique, nous vous invitons à consulter l'article suivant : Probabilité de grossesse avec DPI.
Nous nous efforçons de vous fournir des informations de la plus haute qualité.
🙏 Merci de partager cet article si vous l'avez aimé. 💜💜💜 Aidez-nous à continuer!
Bibliographie
Anthony Homer H. Preimplantation genetic testing for aneuploidy (PGT-A): The biology, the technology and the clinical outcomes. Aust N Z J Obstet Gynaecol. 2019 Apr;59(2):317-324. doi: 10.1111/ajo.12960. Epub 2019 Feb 27.
Rajesh Parikh F, Sitaram Athalye A, Jagannath Naik N, Jayaram Naik D, Ramesh Sanap R, Fali Madon P. Preimplantation Genetic Testing: Its Evolution, Where Are We Today?J Hum Reprod Sci . Oct-Dec 2018;11(4):306-314. doi: 10.4103/jhrs.JHRS_132_18.
Sciorio R, Anderson R. Fertility preservation and preimplantation genetic assessment for women with breast cancer.Cryobiology. 2020 Feb 1;92:1-8. doi: 10.1016/j.cryobiol.2019.12.001. Epub 2019 Dec 18.
Wilding M, Terribile M, Parisi I, Nargund G. Thaw, biopsy and refreeze strategy for PGT-A on previously cryopreserved embryos. Facts Views Vis Obgyn. 2019 Sep;11(3):223-227.
Vos questions fréquentes: 'Le DPI et le PGT sont-ils la même chose ?', 'Quels sont les avantages d'un DPI ?', 'Le fait de retirer une ou plusieurs cellules de l'embryon peut-il nuire à son développement ultérieur ?', 'Le DPI est-il meilleur le troisième ou le cinquième jour ?' et 'Peut-on faire une biopsie du corpuscule polaire ?'.








Comment obtenir un DPI en France ? Y a-t-il certaines exigences et puis-je me rendre dans un centre de procréation assistée pour cela ?
Bonjour Madeleine,
Toutes les cliniques de fertilité ne proposent pas la technique du DPI.
En France, seuls les centres de Paris, Strasbourg, Montpellier, Nantes et Grenoble pratiquent cette technique et il est nécessaire qu’elle soit approuvée par une commission avant de pouvoir être mise en œuvre. Si vous souhaitez avoir une liste des cliniques en France et de leurs services, je vous recommande d’accéder à notre repertoire des cliniques. Vous obtiendrez ainsi des informations sur leurs traitements, des techniques supplémentaires telles que le DPI, des avis et bien plus encore.
Si vous ne savez toujours pas quelle clinique vous convient le mieux ou si vous préférez faire un DPI à l’étranger, vous pouvez utiliser notre rapport de fertilité. Cet outil vous aide à choisir le bon centre de fertilité et le bon traitement en fonction de votre histoire personnelle. Vous obtiendrez également tous les centres de fertilité de votre région, leurs traitements, un devis pour le traitement de fertilité que vous souhaitez utiliser et bien plus encore.
J’espère que cela vous aidera,
Passez une bonne journée.